Redirigir nuestra evolución ha sido, desde hace mucho tiempo, una tentadora posibilidad teórica. Pero es probable que, de pronto, se convierta en una realidad.
El descubrimiento de la estructura de la molécula de ácido desoxirribonucleico (ADN), realizado por James Watson y Francis Crick en abril de 1953, hace 62 años, abrió a la ciencia posibilidades insospechadas. En menos de un siglo han aparecido disciplinas que tienen la capacidad de modificar nuestros alimentos, nuestra salud, e incluso los fundamentos mismos de la sociedad. La biotecnología, por ejemplo, permite agregar (o quitar) genes propios o ajenos a una especie vegetal o animal para mejorar sus características, o inducirlas a producir sustancias necesarias para la vida humana (desde vitaminas extra hasta antibióticos e insulina). Y, a pesar de que es una realidad en plantas y animales desde hace 30 años, hoy continúa la discusión sobre los riesgos de su aplicación a largo plazo.
Pero hoy tenemos enfrente un dilema más inquietante: ¿qué hay con la posibilidad de manipular los genes de nuestra propia especie? Existen muchos argumentos sobre las implicaciones éticas de la clonación humana terapéutica, y el uso de las células troncales, o células “madre” embrionarias; no obstante, hasta ahora se había perdido de vista otra área de la genética que, de acuerdo con científicos y especialistas, tiene probabilidades de convertirse en el mayor logro de la medicina preventiva, pero también de trocarse en la mayor pesadilla utilitarista: los bebés diseñados.
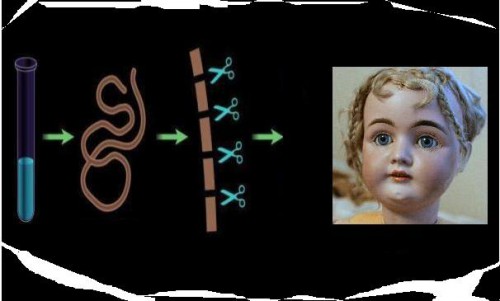
En 2013, cuatro equipos internacionales de investigadores informaron haber dominado un sistema para modificar los genes. La técnica, llamada Clustered Regularly Interspaced Short Palindromic Repeats o CRISPR (Repeticiones Palindrómicas Cortas, Agrupadas con Espacios Regulares), utiliza una enzima que “corta” los genes como una tijera, y una molécula que puede programarse para servirle de guía hasta encontrar ciertas combinaciones de nucleótidos, o “letras”, del ADN (G, A, T, C), que están organizadas de manera similar a un palíndromo (palabras que pueden leerse igual en las dos direcciones). Estas herramientas pueden localizar y modificar con precisión los segmentos de ADN deseados dentro de una célula.
A partir de entonces, varios grupos científicos han aplicado este sistema para borrar, añadir, activar o apagar a voluntad determinados genes, en células de bacterias, levaduras, plantas, moscas, ratas, peces, y también en células humanas, lo que les ha permitido, con mayor rapidez, crear modelos animales para estudiar enfermedades humanas, o los genes individuales y sus interacciones. Actualmente, se considera una tecnología tan precisa que resulta muy promisoria en el desarrollo de terapias génicas para personas que tienen enfermedades devastadoras o mortales.
De hecho, muchos grupos médicos ya utilizan otras herramientas de “edición de genes” en las personas, en terapias que corrigen defectos genéticos, como algunos tipos de anemias. Si se aplica de esta forma, el método CRISPR permitiría corregir directamente un gen defectuoso en las células llamadas “somáticas”, que son todas las del cuerpo, con excepción de las células reproductoras o “germinales” (óvulos y espermatozoides) y, como no afecta a estas últimas, los cambios que se hicieran en el ADN no se transmitirían a las generaciones futuras.
Sin embargo, la técnica también puede emplearse para modificar los genes de las células germinales, en cuyo caso, los cambios podrían heredarse a los descendientes. Por tal motivo, esta alternativa entró recientemente en una zona de controversia.
De acuerdo con un artículo de Antonio Regalado para la revista digital del Instituto Tecnológico de Massachusetts (MIT Technology Review), hasta hace poco la precaución y las cuestiones éticas iban ganado esta controversia, con la prohibición en algunos países (donde no se incluye Estados Unidos) para realizar ingeniería genética en células germinales. En este sentido, una revisión realizada en 2014 por Tetsuya Ishii, bioético de la Universidad Hokkaido en Japón, encontró que de 39 países, 29 tienen leyes o lineamientos que prohíben esa práctica y, con anterioridad, la Convención Europea para los Derechos Humanos y la Biomedicina, declaró que intervenir en el reservorio de genes sería un crimen contra la dignidad y los derechos humanos.
Con todo, señaló Regalado, “esas declaraciones se realizaron antes” de que fuera realmente factible modificar con precisión la línea germinal en primates, lo que sucedió en febrero de 2014, cuando un equipo de científicos chinos consiguió el nacimiento del primer par de monos cuyo ADN fue editado mediante CRISPR.
En el mismo contexto, David Cyranoski refirió en la revista Nature que el genetista Xingxu Huang, parte del equipo chino que consiguió editar exitosamente el genoma de los dos embriones de mono, actualmente busca el permiso del comité ético de su institución para intentar modificar genéticamente embriones humanos descartados, aunque sin la intención de que éstos se conviertan en bebés. Y el biólogo Juan Carlos Izpisua Belmonte, del Instituto Salk, en California, también utiliza técnicas de edición de genes en óvulos no fertilizados, para eliminar mutaciones que causan enfermedades en la mitocondria, la estructura celular que procesa la energía.
Aunque sin el propósito de desarrollar bebés diseñados, estos experimentos ya se efectúan en células germinales humanas, y tanto el artículo del MIT, como el de Nature, sugieren que existen razones para pensar que algunos científicos ya han creado embriones humanos con genomas editados, un conocimiento que posiblemente llegará con rapidez a compañías biotecnológicas y a clínicas de fertilidad, donde podría aplicarse, ahora sí, al desarrollo de bebés, mucho antes de haber resuelto importantes cuestiones de seguridad y de haber dirimido sus implicaciones éticas.
Como primera reacción, el pasado 12 de marzo apareció, en la revista Nature, un artículo editorial firmado por cinco especialistas en biotecnología, entre ellos Edward Lanphier, director ejecutivo de la empresa biotecnológica Sangamo Biosciences, y Fyodor Urnov, creador de otro sistema de edición de genes. En éste, exhortan al gremio científico para que respalde una moratoria para el uso de ésta o de cualquier otra técnica de edición de genes que altere el ADN de esperma, óvulos o embriones humanos, ni siquiera con propósitos de investigación. Su principal objeción es que existe el riesgo de provocar “efectos impredecibles en las generaciones futuras”. Así, refieren que, a diferencia de la edición del genoma en las células somáticas (aquellas que no son germinales), la aplicación de estas técnicas en las líneas germinales es debatible, incluso cuando tuviera una justificación ética, “hasta que se haga posible demostrar resultados seguros y obtener datos comprobables a lo largo de múltiples generaciones”. Además, señalan la posibilidad, no remota, de que esta investigación sea explotada para realizar modificaciones no terapéuticas en futuros bebés.
Poco después, el 19 de marzo, esa posición fue rechazada por un grupo de 18 personalidades, entre ellos el Premio Nobel David Baltimore, Jennifer Doudna, bióloga de la Universidad de California y una de las descubridoras de la tecnología CRISPR, y otros científicos y expertos en ética de Estados Unidos.
En una carta, publicada en la revista Science, éstos argumentaron que, si bien es pertinente abstenerse de producir niños con alteraciones genéticas, hasta que se comprendan mejor la seguridad y las razones médicas para hacerlo, esto no debía detener la investigación básica de las técnicas de edición genética en células germinales y embriones, ni los esfuerzos para determinar si existen aplicaciones clínicas que, en el futuro, pudieran considerarse permisibles. Con la advertencia de que ya es “inminente” el arribo de la tecnología capaz de modificar el ADN de las generaciones futuras, este grupo exhortó a la realización de debates sobre la ingeniería genética en humanos.
Esta inminencia deja atrás las dudas sobre la viabilidad de la técnica y subraya sus implicaciones éticas y sociales. Si la modificación genética llega a convertirse en parte de la práctica médica, podrá generar cambios impresionantes en el bienestar humano, que mejorarían la longevidad y la capacidad de llevar una vida plena y productiva… ¿O, no?

En su versión más romántica, digamos que este método se utilizara únicamente para alterar genes defectuosos o problemáticos. Durante el proceso de fertilización asistida, la edición podría emplearse para retirar un gen peligroso de las células germinales o los embriones; o bien, para diseñar versiones más favorables de algunos genes, como un preventivo contra padecimientos comunes actuales.
De hecho, actualmente se aplican otras técnicas de selección, que también conllevan el riesgo de colocar al ser humano en el nivel de un producto que se elige por sus características. Un método, conocido como Diagnóstico Genético en Preimplante, en lugar de alterar los genes embrionarios, permite revisar el ADN de los embriones producidos por fertilización in vitro antes de que sean implantados, para elegir aquellos más sanos. En las clínicas de fertilidad de Estados Unidos, esto suele sumar unos $4,000 dólares al costo total del procedimiento.
El caso más conocido en el uso de esta técnica, por haber sido el primero, fue el de Adam Nash, seleccionado para nacer en agosto del 2000 por contar con las características genéticas adecuadas para desarrollarse en un niño saludable y, a la vez, mediante un trasplante de las células troncales de su cordón umbilical, salvar la vida a su pequeña hermana, afectada por un raro trastorno genético conocido como anemia de Franconi. Algunos especialistas defienden este procedimiento, porque argumentan que resulta más fácil escoger un embrión sano (o con determinadas características), que modificar otro genéticamente. Sin embargo, ambas técnicas no dejan de evocar una sutil pero escalofriante analogía con la eugenesia.
Porque, como sucedió con la cirugía reconstructiva, madre de la cirugía cosmética, el trecho entre lo necesario y lo deseable puede ser lamentablemente corto, y existe la posibilidad de pasar, en algún momento, de la reparación de genes promotores de enfermedades graves o incapacitantes, a la edición de genes para ofrecer características supuestamente “superiores”, con miras a diseñar “el hijo perfecto”, según preferencias de tamaño, color de ojos, e incluso nivel de inteligencia. Y aun si esto pudiera considerarse un “derecho”, ¿qué pasaría si, como sucede con muchas otras ventajas modernas en las actuales condiciones económicas del mundo, este perfeccionamiento sólo estuviera al alcance de las personas, o de las sociedades, más privilegiadas?
La minúscula probabilidad de que todo el mundo tuviera las mismas oportunidades para mejorar su arsenal genético, a la larga relegaría a la mayoría de los humanos (esa mayoría sin los medios para tener acceso a tal posibilidad) a una subespecie, en el mejor estilo de “Un mundo feliz” o de “GATTACA” , con las consecuencias que eso implica.
Además, existe también el riesgo de producir resultados inesperados, a partir de una mala elección de las particularidades “deseables”, ya que cada conjunto genético tiene características recesivas con funciones evolutivas esenciales, muchas de las cuales todavía nos son desconocidas. Asimismo, y en esto coinciden ambos grupos de expertos, aunque realmente se le diera un uso exclusivamente médico a la corrección de genes asociados con enfermedades, quedan muchas incógnitas. Aun tratándose simplemente de regresar un gen a su forma sana, todavía no es posible predecir todas las consecuencias que tiene modificar las “letras” del ADN de una persona, sobre todo cuando se corrigen varios genes a la vez. Esto podría traer efectos irreversibles, que solamente se advirtieran, o aparecerieran, después de muchas generaciones. Por ejemplo, diminutos cambios en lugares del genoma alejados del objetivo, que podrían modificar de manera inesperada el genoma de cualquier embrión humano alterado con CRISPR.
La selección, y el eventual diseño de bebés, prometen la solución de muchos problemas, bien descartando los embriones defectuosos, o aplicándoles tratamientos preventivos para evitar padecimientos que pudieran desarrollarse más tarde, como algunos tipos de cáncer diabetes, o terribles enfermedades de origen hereditario. A primera vista, esto parecería el remedio perfecto para los males de la humanidad… si no fuera porque, a veces, la humanidad dista mucho de tener la madurez ética y la responsabilidad suficientes para distinguir entre lo esencial y lo banal; entre una patología perniciosa y una mera diferencia peculiar (como el color de ojos), o para reflexionar con cuidado sobre la siempre atractiva tentación de “echarle una manita” a la naturaleza para “mejorar” la especie.
Porque, además de las cuestiones éticas y sociales, queda un aspecto todavía más profundo: el hecho de que realizar la edición de genes en las células germinales humanas cambiaría para siempre el curso de nuestra evolución.
Verónica Guerrero Mothelet (paradigmaXXI@yahoo.com)
Fuente:
Baltimore, D., Berg, P., Botchan, M., Carroll, D., Charo, R., Church, G., Corn, J., Daley, G., Doudna, J., Fenner, M., Greely, H., Jinek, M., Martin, G., Penhoet, E., Puck, J., Sternberg, S., Weissman, J., & Yamamoto, K. (2015). A prudent path forward for genomic engineering and germline gene modification Science, 348 (6230), 36-38 DOI: 10.1126/science.aab1028
Información adicional:
Monkeys Modified with Genome Editing
